前文中,我们介绍了乳腺癌内分泌治疗药物的首将—他莫昔芬(TAM),其一直作为乳腺癌术后辅助内分泌治疗的主要药物。但随着20世纪90年代第三代芳香化酶抑制剂(AI)的问世,使TAM在乳腺癌内分泌治疗的地位便受到了挑战!
接下来,我们继续从历史出发,一起回顾AI的诞生,以及AI与TAM对战的辅助治疗临床研究。

方医生专栏,知其所以然!
芳香化酶抑制(AI)
绝经后女性卵巢功能衰退,体内雌激素70% 以上来自肾上腺产生的雄激素前体经芳香化酶作用而生成。
芳香化酶可催化雄烯二酮和睾丸酮等雄性激素转化成雌二醇和雌酮,是绝经后女性体内雌激素合成的关键酶。
AI可以与芳香化酶结合,导致酶活性的丧失,引起体内雌激素水平的降低,从而抑制乳腺癌细胞的分裂增殖,达到控制乳腺癌的目的。
# 第一代AI的代表药物为氨鲁米特, 在20世纪60年代试验性用于激素敏感性的晚期乳腺癌。但由于影响体内肾上腺皮质激素的代谢,使用时需加用氢化可的松,以及不良反应较大等因素,逐渐为其他新型AI所替代。
# 第二代AI代表药物为法倔唑和福美司坦,亦由于疗效没有优越性,且给药方式不方便,使得第二代AI的使用受到了限制。
# 第三代AI药物,包括阿那曲唑,来曲唑以及依西美坦。第三代AI最早是用于TAM治疗无效的绝经后女性晚期乳腺癌的治疗,而随后一系列的研究证明了它在绝经后早期乳腺癌辅助内分泌治疗的作用,并且比TAM更有效、安全性更高。
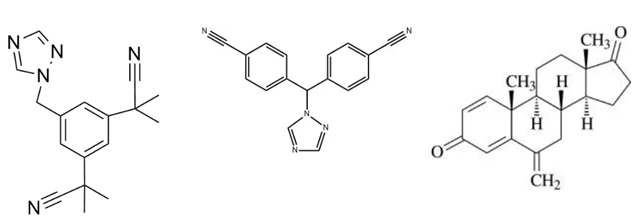
由左到右:
阿那曲唑分子结构式、来曲唑分子结构式、依西美坦分子结构式
图片来源:chemsrc.com、m.chemicalbook.com、yao.dxy.com
阿那曲唑与TAM的临床研究
阿那曲唑最早于1995年在美国上市,1999年经中国国家药品监督管理局批准上市,它是一种强效的选择性非甾体类AI。
为评估阿那曲唑与TAM单用、阿那曲唑联合TAM用于辅助治疗的5年疗效和安全性。
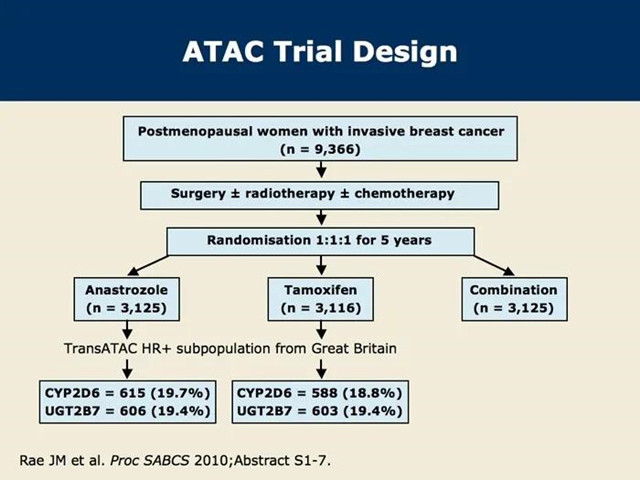
# ATAC研究纳入了1996-2000年共9366名绝经后早期乳腺癌患者,随机分成3组:
◎ 阿那曲唑+安慰剂
◎ TAM+安慰剂
◎ 阿那曲唑+TAM
2002年发表在《柳叶刀》上的初步结果显示,中位随访33.3个月,对于激素受体阳性患者,阿那曲唑组的3年无病生存(DFS)率显著高于TAM组,而阿那曲唑+TAM组较单药TAM组无明显差别。
因此,该试验停止阿那曲唑+TAM组,改为只有阿那曲唑与TAM两组的对比。在不良反应中,子宫内膜癌、阴道出血和分泌物增多、脑血管事件、静脉血栓栓塞事件和潮热方面,阿那曲唑的耐受性优于TAM。
图片来源:researchtopractice.com
2003年及2005年分别报道了随访47个月和68个月的研究结果,均显示阿那曲唑组较TAM组可延长DFS、至复发时间,减少对侧乳腺癌发生风险,但总生存(OS)未显示差异。
基于上述结果,2004年,阿那曲唑用于绝经后女性早期乳腺癌的辅助治疗的新适应证在我国获批。
该试验的10年随访结果进一步证实,对于激素受体阳性的绝经后早期乳腺癌患者,阿那曲唑辅助治疗5年较TAM辅助治疗5年获益更多,总体不良反应更小。因此,ATAC研究奠定了阿那曲唑在绝经后乳腺癌术后辅助内分泌治疗中的地位。
来曲唑与TAM的临床研究
来曲唑于1996年首次在欧盟获批上市,是一种非甾体类AI。为比较来曲唑和TAM作为绝经后激素受体阳性乳腺癌辅助治疗的疗效。
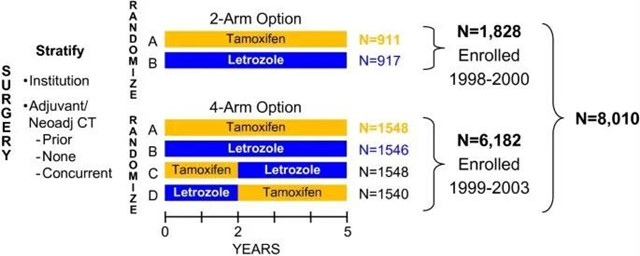
Beat Thürlimann等人开展了BIG 1-98试验,纳入了1998-2000年共1828名患者,随机分成两组:
◎ 5年来曲唑
◎ 5年TAM
之后又纳入了1999-2003年共6182名患者,随机分成4组:
◎ 5年TAM
◎ 2年TAM后3年来曲唑
◎ 2年来曲唑后3年TAM

Beat Thürlimann
图片来源:sggg.ch
# 随访结果显示 #
# 2005年发表了中期随访25.8个月的结果:
这次结果将初始入来曲唑的两组归为来曲唑组(4003例),初始入TAM的两组归为TAM组(4007例)。
与TAM相比,来曲唑组能显著延长DFS,预估两组5年DFS分别为84%和81.4%(P=0.003),来曲唑组乳腺癌术后远处转移的风险降低27%(P=0.006),死亡率下降14%,但没有达到统计学差异。
# 2011年发表了8.1年随访结果显示:
单药来曲唑组显著优于单药TAM组,DFS、OS、无远处转移生存、乳腺癌DFS间隔的风险比分别为0.82、0.79、0.79、0.8。两组序贯用药组与单药来曲唑组相比,上述4个研究终点比较的没有统计学差异。
图片来源:breast-cancer-research.biomedcentral.com
该研究结果证实了对于激素敏感的绝经后乳腺癌患者,来曲唑作为辅助治疗的初始用药优于TAM,可显著降低死亡、复发以及远处复发风险,而与TAM序贯并不优于单药来曲唑。
BIG 1-98试验奠定了来曲唑在绝经后激素受体阳性早期乳腺癌初始辅助内分泌治疗及换药治疗中的地位。
依西美坦与TAM的临床研究
依西美坦的结构与天然雄烯二酮相似,是一种不可逆的AI。为比较2-3年TAM治疗后序贯使用依西美坦至5年,是否在DFS上优于术后5年TAM方案。
Raoul Charles Coombes等人开展了IES-031随机、双盲的对照试验,纳入了1998-2003年共4742例绝经后受体阳性的乳腺癌患者,在手术后先用TAM 2-3年,然后随机分为两组:
◎ 一组改用依西美坦治疗至5年
◎ 另一组继续接受TAM治疗5年

Raoul Charles Coombes
图片来源:imperial.nhs.uk
# 随访结果显示 #
# 中位随访30.6个月结果显示:
依西美坦和TAM组事件数(局部复发或远处转移、对侧乳腺癌或死亡)分别为183与266。依西美坦组的DFS显著优于TAM组,3年DFS分别为91.5%和86.8%,表明依西美坦组患者绝对受益增加了4.7%。
两组之间在OS上没有显著差异。不良反应结果显示,对比TAM组,依西美坦组显著减少妇科综合征、阴道出血、静脉栓塞等不良反应,但关节痛与腹泻显著增加。
# 2007年发表了中位随访55.7个月:
依西美坦组的DFS依然优于TAM组,依西美坦组患者绝对受益增加3.3%。
IES-031试验结果证实2-3年TAM序贯依西美坦至5年比持续5年TAM能显著提高DFS,且能改善患者预后。
结语
AI是辅助内分泌治疗领域继TAM之后的又一类重要治疗药物。对于绝经后激素受体阳性患者,AI无论是初始治疗、序贯还是转换治疗及后续强化治疗,疗效均优于单用TAM。各指南已推荐AI作为绝经后乳腺癌患者辅助治疗的优先选择。
参考文献
[1] 邵志敏,沈镇宇,徐兵河. 乳腺肿瘤学[M].上海:复旦大学出版社,2018.
[2] Baum M, et al. Lancet, 2002,359(9324):2131-2139.
[3] Baum M, et al. Cancer, 2003,98(9):1802-1810.
[4] Howell A, et al. Lancet, 2005,365(9453):60-62.
[5] Cuzick J, et al. Lancet Oncol, 2010,11(12):1135-1141.
[6] Thürlimann B, et al. N Engl J Med, 2005,353(26):2747-2757.
[7] Regan MM, et al. Lancet Oncol,2011,12(12):1101-1108.
[8] Coombes RC, et al. N Engl J Med, 2004,350(11):1081-1092.
[9] Coombes RC, et al. Lancet, 2007,369(9561):559-570.
-本文为原创作品,转载须得授权,侵权必究-
方医生|撰文
尤秋婷医生|审核
常钰滢|排版
 标签来源:内分泌治疗
标签来源:内分泌治疗












